Лекцію для студентів ХНТУСГ проводить Ігор Федорович Коваленко, ст.н.с., к.б.н., відділ низькотемпературного консервування (Інститут проблем кріобіології і кріомедицини НАН України):

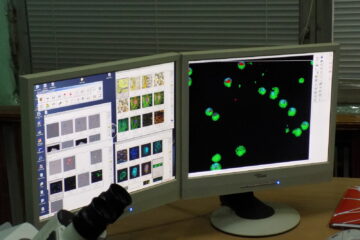
Конфокальний лазерний скануючий мікроскоп LSM 510 META
Конфокальний лазерний скануючий мікроскоп LSM 510 META компанії Carl Zeiss має ряд переваг в порівнянні з іншими аналогічними системами і дозволяє використовувати такі функції:
створення тривимірного (або чотиривимірного з урахуванням часу) зображення зразка з елементами об’ємної реконструкції, анімації та кількісного аналізу;
сканування в режимі мультітрекінга дозволяє, в разі перекривання емісійних спектрів флуоресцентних барвників, послідовно використовувати декілька лазерних ліній (до 4-х) і відповідних детектирующих каналів для отримання чистого, розділеного на окремі компоненти, мультіфлуоресцентного зображення;
МЕТА-детектор дозволяє отримувати інформацію про спектральний розподіл інтенсивності емісійного сигналу;
використання поряд зі звичайним скануванням інших технологій FRAP, FRET з кількісною оцінкою) для дослідження певної довільно обраної ділянки зразка (ROI функція) будь-якої геометричної форми.
Коротко про можливості мікроскопа:
Конфокальний лазерний скануючий мікроскоп LSM 510 META виробляється компанією Carl Zeiss, є модифікацією LSM-мікроскопів і має ряд незаперечних переваг, у порівнянні з аналогічними системами.
Перш за все, модель LSM 510 META використовує всі характерні для всієї серії LSM 510 функції:
створення тривимірного (або чотиривимірного з урахуванням “часової координати”) зображення зразка з елементами об’ємної реконструкції, анімації та кількісного аналізу
сканування методом мультітрекінга, яка дозволяє в разі незначного перекривання емісійних спектрів флуоресцентних барвників, послідовно використовувати декілька лазерних ліній і відповідних детекційних каналів для отримання чистого, розділеного на окремі компоненти, мультіфлуоресцентного зображення
використання разом зі звичайним скануванням інших технологій (FRAP, FRET з кількісною оцінкою) для дослідження певної довільно обраної ділянки досліджуваного зразка (ROI функція) будь-якої геометричної форми завдяки системі AOTF (акустооптичний фільтр), яка дозволяє миттєво з кроком в 0,1% змінювати інтенсивність кожної лазерної лінії від 0 до 100%
Проте головною родзинкою LSM 510 META, його відмінною рисою, є наявність 32-канального метадетектора.
Пройшовши через конфокальную діафрагму, емісійний сигнал, попередньо розкладений на спектральні компоненти, одночасно детектується в 32 незалежних високочутливих каналах. Таким чином, кожна сканована точка (піксель) крім трьох координат несе також і інформацію про спектральний розподіл інтенсивності (Lambda Stack), що в подальшому дозволяє аналізувати мультіфлуоресцентное зображення з високим ступенем поділу спектральних профілів на компоненти, незалежно від ступеня їх перекривання.
Функція незмішуваного лінійного поділу дозволяє піксель за пікселем прецезійно розділяти сумарний сигнал на складові частини та ідентифікувати спектр кожного флуоресцентного барвника окремо. Як спектри порівняння використовують індивідуальні емісійні спектри флуоресцентних маркерів (технологія “Емісійна дактилоскопія”).
Одночасне застосування в конфокальному мікроскопі LSM 510 META технологій мультітрекінга і емісійної дактилоскопії дозволяє усунути проблему перекриття флуоресцентних емісійних спектрів при мультіфлуоресцентному аналізі зображень.
Завдання, які можна вирішити за допомогою конфокального мікроскопа:
Однією з головних сфер застосування конфокального мікроскопа, зумовленої його високою роздільною здатністю і контрастом, є дослідження структури клітин і їх органоїдів, наприклад, цитоскелету, ядра, хромосом, або навіть локалізації в них окремих генів.
Конфокальную мікроскопію застосовують також для дослідження колокалізаціі в клітці двох або більше речовин, наприклад, білків. Такі дослідження допомагають краще зрозуміти, чи існує між ними причинно-наслідковий зв’язок. Попередньо білки позначають антитілами з різними флуорохромами. За допомогою звичайного мікроскопа важко визначити, знаходяться вони поруч або один під іншим. За допомогою конфокальної мікроскопії це можна визначити. Зберігши в пам’яті комп’ютера серію оптичних зрізів, можна провести об’ємну реконструкцію зразка і отримати його тривимірне зображення, не використовуючи трудомістку методику виготовлення та фотографування серійних гістологічних зрізів.
Ще одним завданням для конфокальної мікроскопії є дослідження динамічних процесів, які відбуваються в живих клітинах. Наприклад, рух іонів кальцію та інших речовин через клітинні мембрани. Це можна дослідити на високошвидкісному конфокальному мікроскопі.
Новими перспективними напрямками в конфокальної мікроскопії є методики FRAP (Fluorescence Recovery After Photobleaching – Відновлення флуоресценції після фотовижіганія) і FRET (Fluorescence Resonance Energy Transfer) – Передача енергії за допомогою флуоресцентного резонансу. FRAP використовують для досліджень рухливості біоорганічних молекул шляхом ініціації фотохімічного розпаду флуорохромов в зоні опромінення. Після випалювання молекули з флуорохромом з незасвіченої зони рухаються внаслідок дифузії в засвічену зону зразка. За швидкістю наростання в ній флуоресценції можна робити висновок про рухливість молекул.
FRET застосовують для визначення відстані між молекулами різних типів, їх взаємодії і оточення. Молекули мітять двома флуорохромами зі спектром випромінювання донора, який перекривається спектром поглинання акцептора. В результаті резонансу між енергетичними рівнями енергія від донора передається до акцептору, який знаходиться поруч на відстані близько декількох нанометрів. Імовірність резонансу залежить від відстані між молекулами, тому її можна вимірювати за допомогою конфокального мікроскопа, реєструючи енергію, яка випромінюється акцептором у видимій області спектра.